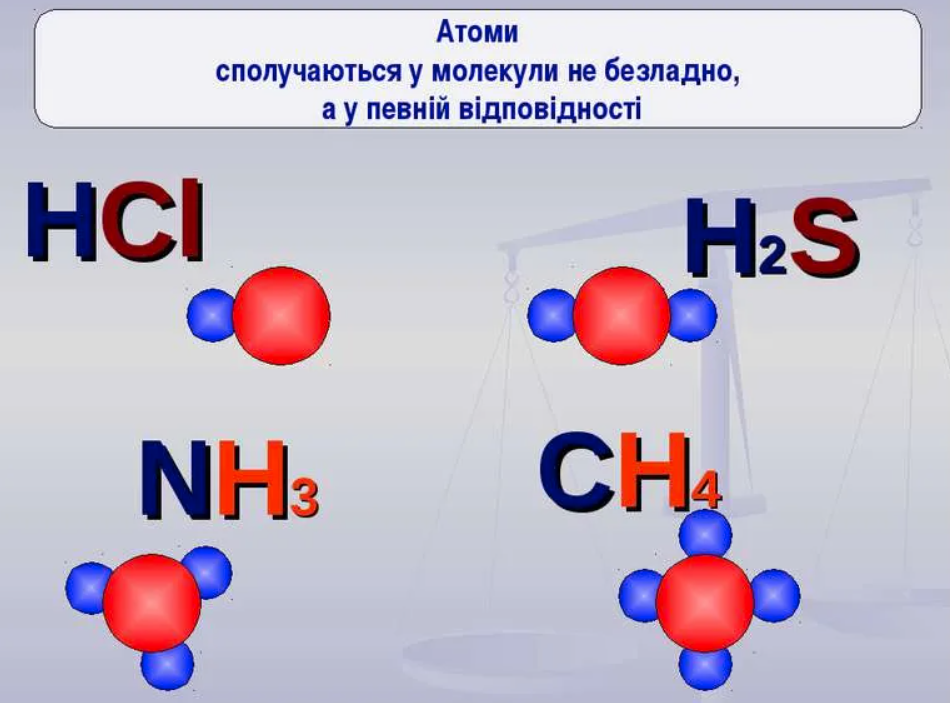
Валентність – це та невидима сила, яка тримає атоми разом, ніби магніт, що притягує друзів на вечірку. У світі хімії вона визначає, скільки “рук” має атом, щоб з’єднатися з іншими, утворюючи молекули, від простої води до складних білків. Ця концепція, народжена в XIX столітті, еволюціонувала від простих ідей до фундаментальної основи сучасної науки, допомагаючи пояснити, чому вуглець стає основою життя, а водень – універсальним партнером.
Коли ми говоримо про валентність хімічних елементів, то маємо на увазі їхню здатність формувати зв’язки. Атоми не просто блукають самотньо; вони шукають компанію, і валентність диктує правила цієї гри. Наприклад, кисень з його двовалентністю завжди готовий обійняти два атоми водню, створюючи H2O – молекулу, без якої життя на Землі було б неможливим.
Історичний шлях валентності: від відкриття до сучасного розуміння
Концепція валентності з’явилася в 1852 році, коли британський хімік Едвард Франкланд запропонував ідею, що атоми мають певну “насиченість” – здатність з’єднуватися з фіксованою кількістю інших атомів. Це було революційно, бо до того хімії бракувало чітких правил для передбачення сполук. Франкланд, спостерігаючи за реакціями металів з органічними сполуками, помітив закономірності, які пізніше розвинули Кекуле та інші в теорію валентності.
З часом валентність набула чіткішого визначення: це число атомів водню або еквівалентних атомів, з якими може з’єднатися атом елемента. У 1916 році Гілберт Льюїс пов’язав її з електронними оболонками, пояснюючи, чому елементи прагнуть заповнити зовнішній рівень до восьми електронів – правило октету. Сьогодні, станом на 2025 рік, валентність інтегрована в квантову хімію, де її розглядають через орбіталі та гібридизацію.
Ця еволюція не була гладкою; спочатку валентність плутали з окисним ступенем, але тепер ми чітко розрізняємо: валентність – про кількість зв’язків, а окисний ступінь – про заряд. Уявіть, як хіміки минулого боролися з цими нюансами, експериментуючи в лабораторіях з примітивним обладнанням, – це додає романтики науковим відкриттям.
Основні типи валентності: постійна, змінна та їхні особливості
Валентність буває постійною, коли елемент завжди проявляє однакову кількість зв’язків, як водень з його одновалентністю. Це робить його передбачуваним партнером у реакціях, ніби вірний товариш, що ніколи не підводить. Постійна валентність характерна для елементів першої групи періодичної системи, де зовнішня оболонка має один електрон, готовий до обміну.
Змінна валентність – це інша історія, повна сюрпризів. Залізо може бути двовалентним у FeO або тривалентним у Fe2O3, залежно від умов реакції. Така гнучкість пояснюється наявністю d-орбіталей, які дозволяють елементу використовувати різні електрони для зв’язків. У 2025 році дослідження показують, що змінна валентність ключова в каталізі, наприклад, у ферментах, де метали переходять між станами, прискорюючи біохімічні процеси.
Ще є ковалентна валентність, де атоми діляться електронами, і іонна, де відбувається повний перенос. У молекулах на кшталт NH3 азот тривалентний, формуючи три ковалентні зв’язки з воднем, а четвертий – донорно-акцепторний. Ці типи переплітаються, створюючи різноманіття сполук, від солей до полімерів.
Як визначати валентність за формулами сполук
Визначення валентності за формулою – це як розгадування головоломки. У бінарних сполуках, наприклад, CO2, вуглець чотиривалентний, бо з’єднаний з двома атомами кисню, кожен з яких двовалентний. Правило просте: добуток валентності одного елемента на його кількість дорівнює добутку іншого.
Для складніших сполук, як H2SO4, сірка шестивалентна, бо пов’язана з чотирма киснями (двовалентними) і двома воднями через кисень. Практично це застосовують у школах: візьміть NaCl, де натрій одновалентний, а хлор – теж, утворюючи простий 1:1 зв’язок. Але пам’ятайте, у органічній хімії валентність може змінюватися через множинні зв’язки, як у етилені C2H4, де вуглець чотиривалентний з подвійним зв’язком.
Цей метод не завжди ідеальний; для елементів з змінною валентністю потрібен контекст реакції. У 2025 році комп’ютерні моделі, базовані на квантовій механіці, точно прогнозують валентність, роблячи хімію точнішою наукою.
Приклади валентності в повсякденній хімії та природі
Візьміть воду: кисень двовалентний, з’єднуючи два водні. Це пояснює, чому вода кипить при 100°C – кутові зв’язки створюють водневі мости, додаючи міцності. У вуглекислому газі CO2 вуглець чотиривалентний з двома подвійними зв’язками, роблячи молекулу лінійною і стабільною в атмосфері.
У біології валентність грає роль у ДНК: фосфор п’ятивалентний у фосфатних групах, тримаючи ланцюг разом. А в металах, як мідь, змінна валентність (одно- чи двовалентна) визначає колір сполук – від синього купрум сульфату до зеленого малахіту. Ці приклади показують, як валентність формує світ навколо нас, від їжі до технологій.
У промисловості валентність допомагає синтезувати полімери: вуглець чотиривалентний у поліетилені, створюючи довгі ланцюги. Без розуміння цього ми не мали б пластику чи ліків. Дивовижно, як така абстрактна ідея впливає на реальність.
Валентність і періодична система елементів
Періодична таблиця – карта валентності. Елементи першої групи, як натрій, одновалентні, втрачаючи один електрон. У шостій групі кисень і сірка двовалентні, приймаючи два. Перехідні метали, як хром, мають валентність від +2 до +6, залежно від орбіталей.
За Менделєєвим, валентність зростає в періоді, досягаючи максимуму в сьомій групі. У 2025 році відкриття нових елементів, як оганесон, показують валентність +2 чи +4, попри нестабільність. Це зв’язує валентність з атомним номером, роблячи таблицю інструментом для прогнозів.
Практичні застосування валентності в науці та технологіях
У фармацевтиці валентність визначає, як молекули взаємодіють з рецепторами. Аспірин, з вуглецем чотиривалентним у кільці, блокує ферменти завдяки точним зв’язкам. У нанотехнологіях валентність графену (вуглець чотиривалентний) дозволяє створювати надпровідники.
Екологічно валентність важлива в очищенні води: залізо тривалентне в коагулянтах, видаляючи забрудники. У 2025 році, з кліматичними викликами, валентність допомагає розробляти каталізатори для захоплення CO2, де метали змінюють валентність для ефективності.
Навіть у кулінарії: валентність солі (NaCl) впливає на смак, бо іони дисоціюють. Це робить хімію частиною щоденного життя, додаючи шар розуміння до простих речей.
Цікаві факти про валентність
- Вуглець може проявляти валентність від 0 у фулеренах до 4 у алмазі, роблячи його “королем елементів” – факт, відкритий у 1985 році з відкриттям фулеренів.
- У деяких сполуках, як NO, азот має фракційну валентність через резонанс, що бентежить студентів, але пояснює стабільність молекули.
- Найвища валентність – у осмію, до +8 у OsO4, використовуваному в мікроскопії для фарбування тканин.
- Валентність впливає на колір: мідь двовалентна дає синій, одновалентна – червоний, як у склі старовинних вітражів.
- У космосі валентність пояснює склад метеоритів, де залізо часто двовалентне, натякаючи на позаземні процеси.
Ці факти додають магії хімії, показуючи, як валентність ховає таємниці в повсякденному.
Типові помилки при роботі з валентністю та як їх уникнути
Багато новачків плутають валентність з окисним ступенем, думаючи, що вони ідентичні. Але валентність – про кількість, а окисний ступінь – про баланс зарядів. Наприклад, у SO2 сірка чотиривалентна, але окисний ступінь +4. Розрізняйте, аналізуючи формулу.
Інша помилка – ігнорування змінної валентності в реакціях. Залізо може окислюватися до +2 чи +3, залежно від pH, що впливає на продукти. Перевіряйте умови, щоб уникнути помилок у розрахунках.
У органічній хімії забувають про множинні зв’язки: у C2H2 вуглець чотиривалентний з потрійним зв’язком. Рахуйте кожен зв’язок як одиницю, і помилки зникнуть. Ці поради роблять вивчення валентності приємнішим.
Таблиця порівняння валентності поширених елементів
Ось таблиця з валентностями ключових елементів для швидкого огляду:
| Елемент | Символ | Типова валентність | Приклад сполуки |
|---|---|---|---|
| Водень | H | 1 | HCl |
| Кисень | O | 2 | H2O |
| Азот | N | 3, 5 | NH3, HNO3 |
| Вуглець | C | 4 | CH4 |
| Залізо | Fe | 2, 3 | FeO, Fe2O3 |
Дані базуються на стандартних хімічних довідниках, таких як Вікіпедія (uk.wikipedia.org) та освітні ресурси PCC Group. Ця таблиця спрощує запам’ятовування, але пам’ятайте про винятки в специфічних сполуках.
Валентність – не просто теорія; вона пульсує в кожній реакції, від лабораторії до зірок. Розуміння її відкриває двері до інновацій, роблячи хімію живою пригодою. Продовжуйте експериментувати, і хто знає, які відкриття чекають попереду.