Іржа, що повільно роз’їдає металевий цвях під дощем, ховає в собі драму змін. Залізо, спокійно лежачи в повітрі як Fe з нульовим ступенем окиснення, раптом оживає, коли кисень краде його електрони, перетворюючи на Fe³⁺ у бурій оксиді. Ступінь окиснення — це умовний заряд атома в сполуці, розрахований ніби всі зв’язки йонні, з повним зміщенням електронних пар до елементів з вищою електронегативністю. Ця цифра миттєво показує, скільки електронів атом “віддав” чи “втратив”, роблячи його окисником чи відновником у реакціях.
Уявіть елементи як акторів на сцені хімії: ступінь окиснення диктує їхню роль — від спокійного глядача (нуль) до запеклого бійця (+7 чи -2). Для водню в H₂O це +1, бо кисень хапає пару; для кисню — -2, як королева, що править у більшості сполук. А в пероксиді H₂O₂? Тут усе перевертається — обидва по -1, ніби компроміс у шаленій гонитві за електронами.
Цей інструмент не просто абстракція шкільних зошитів. Він розкриває, чому мідь зеленіє на дахах, чому батареї в смартфонах живуть довше, і навіть як ферменти в крові керують киснем. Розберемося крок за кроком, з прикладами, що запам’ятаються назавжди.
Історія відкриття: від Берцеліуса до сучасних стандартів
Уявіть XIX століття, коли хімія нагадувала детективний роман. Якось шведський геній Йонс Якоб Берцеліус, спостерігаючи реакції, запропонував розглядати сполуки як сукупність йонів — атомів з “уявними” зарядами. Це народило перші кроки до ступеня окиснення, хоч і без точної назви. Тоді вважали, що зв’язки завжди йонні, як у солях NaCl (Na⁺, Cl⁻).
На зламі століть Гілберт Н. Льюїс ввів електронні пари, показавши ковалентні зв’язки, але ступінь окиснення вижив як зручний “шорткат”. У 1940-х IUPAC стандартизував правила, враховуючи електронегативність за Полінгом. Сьогодні, станом на 2026 рік, це фундамент для комп’ютерного моделювання реакцій у квантовій хімії. Без нього не обійтися в проектуванні каталізаторів для зеленої енергії.
Цікаво, що спочатку плутали з валентністю — числом зв’язків. Але ступінь окиснення гнучкіший: може бути дробовим, як -1/2 для кисню в супероксиді KO₂. Історія вчить: прості ідеї еволюціонують, стаючи потужнішими.
Основні правила визначення ступеня окиснення
Визначення ступеня окиснення нагадує розгадку кросворду: є фіксовані “букви” і логіка суми. Почніть з простого речовини — будь-який елемент там має 0, бо нейтральний, як O₂ чи Fe.
У складних сполуках дотримуйтеся алгоритму. Спочатку запишіть формулу, потім застосуйте правила пріоритету. Перед списком ось ключ: це дозволяє швидко балансувати рівняння окисно-відновних реакцій, де СО змінюється.
- Сума СО в нейтральній молекулі = 0. У NaCl: якщо Cl -1, то Na +1.
- У йонах сума = заряду іона. У SO₄²⁻: S + 4×(-2) = -2, тож S +6.
- Прості речовини: 0. H₂, Cl₂ — атоми рівні.
- Лужні метали (група IA): +1. K, Na завжди віддають один электрон.
- Лужно-земельні (IIA): +2. Ca, Mg — стабільні катіони.
- Фтор: завжди -1. Найелектронегативніший, краде у всіх, навіть у O в OF₂ (O +2!).
- Гідроген: +1, крім металогідридів як NaH (-1).
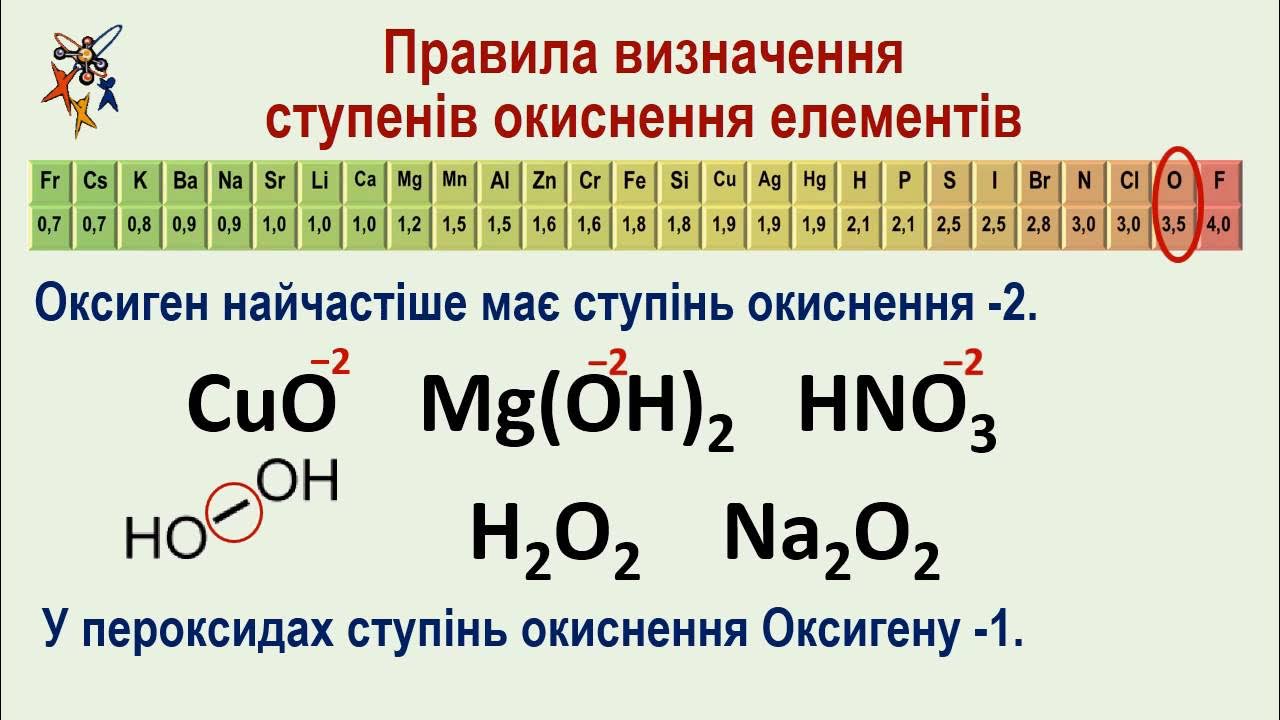
- Кисень: -2, винятки нижче.
Цей список — ваш щит від хаосу. Після нього переходьте до невідомих: віднімайте відомі від суми. У KMnO₄: K +1, O₄ -8, сума 0, тож Mn +7. Логічно й точно, ніби пазл складається сам.
Постійні та змінні ступені окиснення елементів
Елементи — як хамелеони: одні фіксовані, інші міняють “маскування”. Метали головних груп мають постійні СО, близькі до номеру групи. Перехідні ж, як залізо, грають ролями від 0 до +6.
Ось таблиця характерних ступенів окиснення для груп періодичної системи. Вона спрощує життя, показуючи найпоширеніші значення (жирним — типові). Дані з uk.wikipedia.org, де базуються на класичних таблицях Менделєєва та Грінвуда.
| Група | Елементи | Типові СО | Приклади |
|---|---|---|---|
| IA | Li, Na, K | +1 | NaCl |
| IIA | Be, Mg, Ca | +2 | MgO |
| VIIA (галогени) | F, Cl, Br, I | -1, +1/+5/+7 (крім F) | HF, ClO₄⁻ |
| Перехідні (VIII) | Fe, Mn, Cr | +2/+3/+6/+7 | Fe₂O₃ (+3), KMnO₄ (+7) |
| VA | N, P | -3/+3/+5 | NH₃ (-3), HNO₃ (+5) |
Джерело: uk.wikipedia.org/wiki/Список_ступенів_окислення_хімічних_елементів. Ця таблиця ілюструє, чому фосфор у PH₃ -3 (відновник), а в H₃PO₄ +5 (окисник). Варіації залежать від електронегативності партнерів — у бінарних з металами неметали негативні, з киснем — позитивні.
Практичні розрахунки: від простих до хитрих сполук
Давайте поринемо в приклади, ніби в лабораторію. Почніть з бази: у H₂SO₄ H₂ +2, O₄ -8, сума 0, S +6. Легко? Тепер складніше — Fe₃O₄ (магнетит). O₄ -8, три Fe дають +8, середній +8/3 ≈ +2.67, але реально два Fe²⁺ (+4) і один Fe³⁺ (+3). Середній СО корисний для стехіометрії.
У органіці: CH₄ — C -4 (4H по +1). CO₂ — C +4. А в етиловому спирті CH₃CH₂OH? Перший C -3, другий -1, O -2, H +1. Алгоритм: рахувати від периферії, вважаючи C-C зв’язок 0.
Ще один трюк: у комплексах як [Fe(CN)₆]⁴⁻. CN вважається CN⁻ (C+2, N-3), шість — -6, заряд -4, Fe +2. Практика робить майстра — спробуйте самі з K₂Cr₂O₇: Cr +6.
Винятки, що ламають правила: пероксиди, супероксиди та дробові значення
Хімія любить сюрпризи, як фтор у OF₂, де кисень +2! Бо F -1×2=-2, сума 0, O +2. Пероксиди (H₂O₂, Na₂O₂) — O-O зв’язок, кожен O -1. Супероксиди KO₂ — O₂²⁻, середній -1/2. Озоніди KO₃ — -1/3.
Дробові СО не міф: у Pb₃O₄ два Pb⁴⁺ (+8), один Pb²⁺ (+2), середній +8/3. У металах як Pb₃O₄ це змішані оксиди. Для просунутих: реальний заряд за Bader аналізом близький, але формальний СО — спрощення. У 2026 році в квантових розрахунках DFT використовують гібридні моделі для точності.
Ступінь окиснення проти валентності: де різниця?
Валентність — число зв’язків, завжди натуральне (IV для C у CH₄). СО враховує напрямок: у CH₄ валентність C=4, СО -4. У CO валентність 2, СО C+2, O-2. Валентність статична, СО динамічна — показує “окисненість”. У перехідних елементах валентність = |СО|, але не завжди.
Плутанина виникає в органіці: валентність N=3 у NH₃, СО -3. Зрозумійте: валентність — “руки”, СО — “енергія” в них.
Роль у окисно-відновних реакціях
Ось де СО сяє: у реакціях СО окисника падає (приймає e⁻), відновника росте. У 4Fe + 3O₂ → 2Fe₂O₃: Fe 0→+3 (відновник), O 0→-2 (окисник). Баланс: 12e⁻ з Fe, 6O×2e⁻=12.
Метод СО полегшує: запишіть зміни, знайдіть НСК, помножте. У кислотах/лугах додають H₂O, H⁺/OH⁻. Це рятує в аналітичній хімії та промисловості.
Сучасні застосування: від батарейок до біології
У літій-іонних акумуляторах LiCoO₂: Co +3, при розряді →Co²⁺, Li⁺ рухається. Нові Ni-Mn-Co (NMC) грають СО для стабільності — до 500 циклів у 2026 моделях Tesla. У каталізі Pt у паливних елементах міняє СО 0/+2 для окиснення H₂.
Біохімія: у гемоглобіні Fe²⁺→Fe³⁺ при зв’язуванні O₂, метгемоглобінемія — хвороба високого СО. Ферменти як цитохроми використовують Cu/Fe з змінними СО. У медицині: хлоргексидин (Cl +5 у реакціях) дезінфікує. Екологія: озон (O 0, але в O₃ середній 0) очищує воду.
У нанохімії 2026: графенові каталізатори з N-допінгом міняють СО C для розкладання CO₂.
Типові помилки при визначенні ступеня окиснення
- Забувають винятки для O: У H₂O₂ пишуть -2 замість -1, ламаючи суму.
- Плутанина H у гідридах: NaH — H -1, не +1, бо метал!
- Ігнор заряду іона: У Cr₂O₇²⁻ Cr +6, бо -14O +2 заряд = 2Cr×+6.
- Органіка без порахунку: У глюкозі C варіює від 0 до +4, не монолітно.
- Дробові ігнор: Pb₃O₄ не +4 всюди, середній +8/3.
Уникайте, перевіряючи суму двічі — це врятує від ганьби на іспиті чи в лабі. Джерело: uk.wikipedia.org.
Ці нюанси перетворюють хаос на симфонію реакцій. Уявіть, як СО керує синтезом ліків чи очищенням води — скрізь ця невидима сила. Експериментуйте з формулами, і хімія відкриється з нового боку, повна несподіванок і відкриттів.