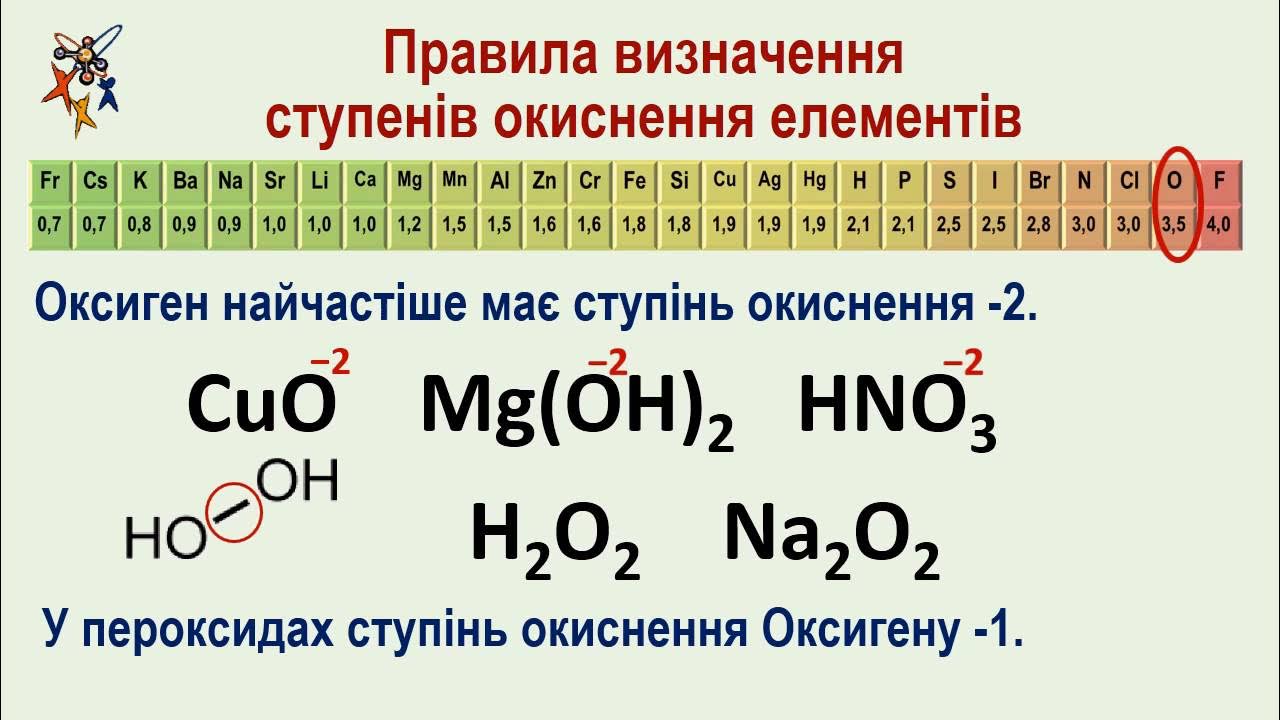
Формула NaCl ховає просту таємницю: натрій несе +1, хлор –1, бо сума зарядів у нейтральній молекулі завжди нульова. А в пероксиді водню H₂O₂ кисень несподівано тримає –1, а не звичні –2. Ступінь окиснення – це умовний заряд атома, ніби всі зв’язки стали чисто йонними, і його легко обчислити за фіксованими правилами. Ці правила дозволяють розкрити “електронний баланс” будь-якої сполуки, від солей до складних іонів.
Уявіть атоми як акторів на сцені хімії: одні віддають електрони, стаючи позитивними, інші забирають, набираючи негатив. Фтор завжди грає ролі “хижака” з –1, а в простих речовинах усі актори нейтральні – 0. З цими базовими принципами ви миттєво розберете більшість формул, а далі розберемо нюанси, які роблять хімію справжньою пригодою.
Цей інструмент незамінний не тільки в шкільних задачах, але й у реальному житті – від балансування реакцій у лабораторіях до розуміння, чому літій-іонні акумулятори 2026 року тримають заряд завдяки Co(+3/+4). Готуємося зануритися глибше, з купою прикладів і хитрощів.
Що ховається за поняттям ступеня окиснення
Ступінь окиснення виникає, коли ми уявляємо зв’язок між атомами як повне перекидання електронів до більш електронегативного партнера. Це не реальний заряд, а умовна величина, яка показує, скільки електронів атом “віддав” чи “взяв”. Позитивне число говорить про втрату електронів – окиснення, негативне – про набуток, відновлення. У 1789 році Антуан Лавуазьє заклав основу, називаючи окиснення “насиченням киснем”, але сучасне визначення від IUPAC уточнює його як формальний заряд у йонній моделі.
На відміну від валентності, яка рахує зв’язки, ступінь окиснення може бути дробовим чи нульовим, ігноруючи ковалентність. У сполуках металів з неметалами він часто збігається з іонним зарядом, але в органічних молекулах розкриває тонкі нюанси. Ця концепція оживає в реакціях окисно-відновних процесів, де зміна ступеня сигналізує про перебіг перетворень.
Чому це круто? Бо з нею ви прогнозуєте поведінку речовин: високий позитивний ступінь робить елемент окисником, низький негативний – відновником. У батареях Tesla чи смартфонах кобальт коливається між +3 і +4, забезпечуючи енергію на мільйони циклів.
Основні правила визначення ступеня окиснення
Хімія любить порядок, тож правила – як паспорт для атомів. Вони базуються на електронегативності та нейтральності сполуки. Перед списком запам’ятайте: позначайте невідоме як x, множте на індекси, рівняння суми дорівнює 0 (молекула) чи заряду іона.
- У простих речовинах (H₂, O₂, Fe) – 0. Атоми одного елемента не крадуть електрони один в одного, тож нейтральні. Виняток рідкісний – озон O₃, але для шкільних задач ігноруємо.
- Лужні метали (Li, Na, K) – +1, лужноземельні (Mg, Ca) – +2. Вони стабільно віддають 1 чи 2 електрони, як у солях NaCl чи CaO.
- Фтор у сполуках – –1 завжди. Найелектронегативніший, тиран таблиці Менделєєва, забирає пару в усіх.
- Кисень – –2, з винятками. Стандарт у оксидах, але в пероксидах (H₂O₂) –1, супероксидах (KO₂) –½, фторидах кисню (OF₂) +2. Ці пастки ловлять багатьох.
- Водень – +1, крім металгідридів (NaH) – –1. З неметалами віддає, з металами бере.
- Галогени (Cl, Br, I) – –1 у бінарних з менш е/н елементами. Але в оксихлорах +5,+7 тощо.
- Сума всіх ступенів у молекулі = 0, в іоні = заряд іона. Головне рівняння для x.
Ці правила покривають 95% випадків. Після списку переходьте до алгоритму – і жодна формула не встоїть. За даними uk.wikipedia.org, вони узгоджені з глобальними стандартами.
Покроковий алгоритм: як визначити ступінь окиснення за формулою
Обчислення – як детективна гра: збираємо відоме, розкриваємо невідоме. Ось чіткий план для будь-якої сполуки.
- Запишіть формулу, підкресліть індекси. Для KMnO₄: K, Mn, 4O.
- Присвойте фіксовані значення: K +1, O –2.
- Поставте рівняння: 1*(+1) + x + 4*(-2) = 0.
- Розв’яжіть: +1 + x – 8 = 0 → x = +7 для Mn.
- Запишіть: +1K +7MnO4–2.
- Для іонів додайте заряд: у SO₄²⁻ сума = –2.
Спробуйте на Cr₂O₇²⁻: O –2*7=–14, заряд –2, два Cr: 2x –14 = –2 → 2x=12 → x=+6. Легко? Тепер ускладнимо прикладами нижче, бо реальність кидає виклики.
Таблиця типових ступенів окиснення ключових елементів
Ця таблиця – ваш шпаргалка, розширює правила для змінних елементів. Групи за валентністю, з прикладами сполук.
| Елемент | Типові ступені | Приклади сполук |
|---|---|---|
| Вуглець (C) | –4, 0, +2, +4 | CH₄ (–4), CO (+2), CO₂ (+4) |
| Азот (N) | –3, –1, 0, +1, +3, +5 | NH₃ (–3), N₂O (+1), HNO₃ (+5) |
| Сірка (S) | –2, 0, +4, +6 | H₂S (–2), SO₂ (+4), H₂SO₄ (+6) |
| Хлор (Cl) | –1, +1, +3, +5, +7 | HCl (–1), ClO⁻ (+1), HClO₄ (+7) |
| Залізо (Fe) | +2, +3 | FeO (+2), Fe₂O₃ (+3) |
| Марганець (Mn) | +2, +4, +6, +7 | MnO (+2), MnO₂ (+4), KMnO₄ (+7) |
Дані адаптовано з uk.wikipedia.org та рекомендацій IUPAC. Використовуйте для швидкого орієнтування, але завжди перевіряйте рівнянням – таблиця не замінить логіку.
Прості приклади: від солей до оксидів
Почніть з легкого, як розгін велосипеда. У CaCO₃: Ca +2, O –2*3=–6, C x: +2 + x –6=0 → x=+4. Кальцій віддав стабільно, вуглець у карбонаті +4, типово для CO₃²⁻.
Ще: H₂SO₄. H +1*2=+2, O –2*4=–8, S x: +2 + x –8=0 → x=+6. Сірка в кислоті на піку сили. А в FeCl₃: Fe x, Cl –1*3=–3, x–3=0 → x=+3. Класика для іржі та каталізу.
- У NH₄⁺: H +1*4=+4, N x, x+4=+1 → x=–3. Азот ховається негативно в амонії.
- NO₃⁻: O –2*3=–6, N x, x–6=–1 → x=+5. Нітрат-іон, де азот окисник.
- PCl₅: Cl –1*5=–5, P x= +5. Фосфор тримає максимум.
Ці приклади тренують інтуїцію. Тепер до пасток, де правила грають у хованки.
Складні випадки: винятки та змішані ступені
Хімія як джунглі – повно винятків. У H₂O₂: H +1*2=+2, O x*2= –2 → x=–1. Пероксидний місток робить кисень слабшим “збирачем”. У KO₂: K +1, O x*2= –1 → x=–½. Супероксид, де кисень поділяє пару.
Найдикий: OF₂. F –1*2=–2, O x= +2. Кисень окиснює фтор! У Mg₂Si: Mg +2*2=+4, Si x= –4. Кремній як метал у силіцидах.
Змішані: Fe₃O₄. Розбийте на FeO·Fe₂O₃: Fe +2, два Fe +3, O –2. Перевірка: (+2) + 2(+3) + 4(–2)= +2+6–8=0. Марганець у Mn₃O₄ аналогічно +2/+3.
У координаційних: [Fe(CN)₆]⁴⁻. CN –1*6=–6, Fe x, x–6=–4 → x=+2. Ціаніди тримають фіксований заряд. Винятки додають перцю, але алгоритм рятує.
Ступінь окиснення в органічних сполуках
Органіка здається хаосом, але правила ті ж. У метані CH₄: H +1*4=+4, C x= –4. Вуглець на дні, повний відновник.
Еволюціонуймо: CH₃OH (метанол) – C пов’язаний з 3H(+1), OH(O–2, H+1). x +3(+1) + (–2 +1)=0 → x +3 –1=0 → x=–2. Формальдегід HCHO: C з H(+1), H(+1), O(–2) → x+1+1–2=0 → x=0.
- Ацетальдегід CH₃CHO: C1 (CH₃) –3, C2 (CHO) +1, перевірка суми 0.
- Цукрова глюкоза C₆H₁₂O₆: кожен C в середньому 0, але детально варіює.
- Етанова кислота CH₃COOH: CH₃ –3, COOH +3.
У органічних реакціях зміна ступеня C від –4 до +4 пояснює окиснення алкоголів до альдегідів. Корисно для біохімії, де NAD+ грає з окисненням.
Типові помилки початківців і як їх уникнути
Багато хто спотикається на кисні, забуваючи пероксиди. Уявіть: учень бачить H₂O₂, пише O –2, виходить нісенітниця з H +1. Радість: завжди шукайте подвійний зв’язок O-O!
Інша класика – ігнор заряду іона. У CrO₄²⁻ пишуть Cr +6 без врахування –2, забуваючи суму –2. Ще: плутають з валентністю, думаючи Cl у HClO₄ валентний 1, а не +7.
- Помилка: У F₂O писати F –1, O –2. Правильно: O +2, F –1*2.
- Змішані оксиди: Fe₃O₄ як три +8/3. Розбивайте на частини.
- Органіка: забувати H +1 у всіх C-H. Рахуйте методично.
- Дробові: KO₂ як O –2. Враховуйте стехіометрію.
Порада: тренуйтеся на 10 формулах щодня, перевіряйте сумою. З часом інтуїція виросте, як м’яз. Уникайте цих ям – і хімія засяє.
Тепер ваша черга: візьміть HNO₂, PO₄³⁻ чи C₆H₅CHO і розберіть. З цими інструментами жодна реакція не злякає, а світ хімії відкриє нові горизонти – від каталізаторів до зеленої енергії.